塩基はOHからなる化合物です–イオンを生成し、陽子を受け入れます。化学における塩基とは、赤いリトマスブルーに変わる化合物で、酸と反応すると反応を中和して塩と水が得られます。塩基の pH 値は 7 より大きく、味は苦く、触ると滑りやすいです。水に溶ける塩基をアルカリといいます。塩基の例としては、金属酸化物、金属水酸化物などが挙げられます。私たちが日常生活で使用する塩基の例としては、石鹸が挙げられます。この記事では、塩基の定義、性質、化学反応について詳しく学びます。

基本定義
塩基は、pH 値が 7 を超える化合物として定義され、プロトンを受け取り、酸を中和し、赤いリトマス試験紙を青に変えます。彼らは通常、OHを解放します–解離時のイオン。例としては、NaOH、NaHCO が挙げられます。3、以下は、ベースによって示されるいくつかの一般的な機能です。
- 苦い味がする
- 触ると滑りやすいです
- 彼らはレッドリトマスブルーに変わる
- 彼らはOHを解放する–水に溶けたイオン
- 溶液の形で電気を伝導します
塩基は、日常生活で使用される最も重要な化合物の 1 つです。塩基は、酸性度を制御するための制酸剤として、また口内で酸を生成する細菌の作用を中和してエナメル質や虫歯の劣化を防ぐために歯磨き粉に使用されます。ベーキングパウダー、重曹、洗剤としても使用されます。
ルイスベース
ルイス塩基は電子対を持つ化合物であり、電子対が欠損している化合物に電子対を与えることができます。ルイス塩基は本質的に求核性です。つまり、核を好む性質があり、電子対で正に帯電した中心を攻撃することを意味します。ルイス塩基の例には、アンモニア (NH) が含まれるため、アンモニアが含まれます。3) 中心原子の窒素には 5 つの電子があり、そのうち 3 つは 3 つの水素原子との結合に使用され、1 対の電子が N 原子に残されたままになり、NH が生成されます。3ルイスベース。
アレニウス基地
アレニウスの概念によれば、塩基は水に溶解すると水酸化物イオンを放出し、水溶液中のヒドロキシルイオンの濃度を増加させる化合物です。たとえば、KOHを水に溶かすとOHが得られます。–イオンを生成し、OH 濃度を増加させます。–水中で。
ブレンステッドベース
ブレンステッド塩基の概念は、塩基が H を受け入れる化合物であると述べているアレニウスの概念の発展版です。+イオンまたはプロトンが共役酸を形成します。たとえばCl–Hを受け入れるベースです+共役酸として HCl を形成します。
塩基の種類
塩基は、酸性度、濃度、イオン化能力に基づいて分類できます。分類は以下に記載されています
酸性度に基づく塩基の種類
塩基の酸性度は、塩基1分子中に存在する置換可能な水酸基の数を指します。酸性度に基づいて、塩基は 3 つのカテゴリに分類されます。
- 一酸塩基
- 二酸塩基
- 三酸塩基
一酸性: 一酸性塩基は、置換可能なヒドロキシルイオンを 1 つだけ含み、水素イオンを 1 つだけと相互作用する塩基です。一酸性塩基には、NaOH、KOH などが含まれます。
二酸性: 二酸塩基は、2 つの水素イオンと相互作用する 2 つの置換可能なヒドロキシル イオンを持つ塩基です。 Ca(OH)2、Mg(OH)2、および他の二酸塩基が例です。
三酸性: 三酸塩基は、3 つの置換可能なヒドロキシル イオンと 3 つの水素イオンで構成される塩基の一種です。三酸塩基にはAl(OH)が含まれます3、Fe(OH)3、 その他。
水溶液中の濃度に基づく塩基の種類
濃度は、水溶液中に存在する塩基の量を指します。塩基は、水溶液中の濃度に基づいて 2 つのカテゴリに分類されます。
- 濃縮ベース
- 希釈ベース
濃縮ベース: 濃塩基とは、溶媒に比べて塩基の量が多いものです。たとえば、濃NaOH溶液。
希釈ベース: これらのタイプの塩基は、水溶液中の塩基濃度が低くなります。希釈は、より多くの量の溶媒を加えることによって溶質の割合を減らすプロセスです。たとえば、希釈した NaOH、希釈した KOH などです。
イオン化度による塩基の種類
イオン化度は、水に溶解したときに化合物が構成イオンを遊離する能力を指します。塩基の場合、イオン化度は塩基が OH を放出する能力を指します。–水に溶けるとイオンになります。塩基はイオン化の程度に基づいて 2 つのタイプに分類されます。
- 強力なベース
- 弱塩基
強力なベース: 強塩基は、水に溶解すると完全に解離し、OH- イオンを遊離する塩基です。強塩基の例には、NaOH、KOH などが含まれます。
弱塩基: 完全に解離せず、OH- イオンの一部のみを遊離する塩基は、弱塩基と呼ばれます。弱塩基の例には、Al(OH) が含まれます。3、銅(OH)2、等
もっと詳しく知る、 強塩基と弱塩基
塩基の性質
塩基は、OH- イオンを持ち、赤リトマス青などに変わる化合物であることはご存知のとおりです。このセクションでは、塩基の物理的および化学的性質と、その一般的な性質についての簡単な知識について学びます。
塩基の一般的性質
Base の一般的なプロパティを以下に示します。
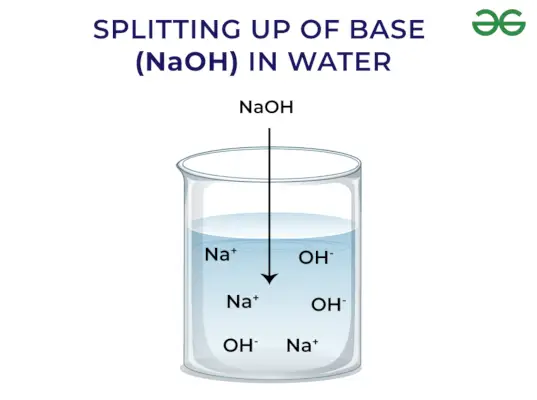
- 水酸化物イオン(OH)–) は塩基によって水中に放出されます。より多くのイオンが放出されるほど、塩基は強くなります。
- 塩基は酸と反応して塩を形成します。 酸は塩基と反応します。この塩基と酸の反応を中和反応といいます。
- 塩基は赤のリトマス試験紙を青に変えます。
- タンパク質の構造は塩基によって変化することがあります。ベースにはこの性質があり、滑らかな感触を与えます。石鹸は濡れていると肌の上で驚くほど滑りやすくなる基剤です。一部の強力な塩基はタンパク質の構造を変更する能力があるため、非常に危険です。
塩基の物性
ベースの味は苦い: ベースは苦い味がします。苦みがあるため、アルカリ性の食品はほとんどありません。アルカリ性食品素材はごくわずかです。塩基は酸と比較してより注意して味見する必要があります。
dbms の酸のプロパティ
ベースは触ると滑りやすい: ベースに触れると滑りやすくなります。例えば石鹸。
塩基放出OH – イオン: 塩基が水に溶解すると、ヒドロキシルイオン(OH)が放出されます。–)。ヒドロキシルイオンを遊離する能力に応じて、それらは強いものと弱いものに分類されます。
塩基は酸を中和します。 塩基が酸と反応すると、お互いが中和され、塩と水が生成されます。この反応はと呼ばれます 中和反応 。酸HYと塩基「XOH」があるとします。その場合、形成される塩は「XY」になります。この反応の方程式は、HY + XOH → HOH + XY として与えられます。
塩基はタンパク質を変性します: タンパク質の変性とは、タンパク質の安定性と構造が破壊されることを意味します。人間の皮膚や毛髪はタンパク質で構成されており、灰汁とも呼ばれる水酸化ナトリウムや水酸化カリウムなどの強アルカリを使用すると、人間の皮膚に悪影響を与えるため、人体に有害な塩基を使用します。
塩基が赤のリトマス試験紙を青に変える: 塩基を赤いリトマス試験紙に接触させると青色に変わります。ただし、乾燥塩基を赤いリトマス試験紙で反応させようとしても、そのような変化は観察できないことに注意してください。リトマス試験紙テストは、ベースをテストするための最も古い方法の 1 つです。ただし、フェノールフタレインなどの他の指示薬も存在します。
塩基は電気を伝導します: 塩基が溶液の状態にある場合、塩基は移動可能な OH- イオンを持っているため、電気を通すことができます。
塩基の化学的性質
- 塩基と金属の反応: アルカリ(塩基)と金属が反応すると、塩と水素ガスが発生します。
アルカリ+金属 → 塩+水素
例:
- 水酸化ナトリウムが金属アルミニウムと反応すると、アルミン酸ナトリウムと水素ガスが発生します。
2 NaOH + 2 Al + 2 H 2 O→2NaAlO 2 + 2時間 2
- 水酸化ナトリウムが金属亜鉛と反応すると、水素ガスと亜鉛酸ナトリウムが生成されます。
2 NaOH + 亜鉛 → Na 2 ZnO 2 +H 2
- 非金属酸化物と塩基の反応: 非金属酸化物が塩基と反応すると、塩と水が形成されます。
非金属酸化物+塩基→塩+水
塩基である水酸化カルシウムが二酸化炭素と反応すると、炭酸カルシウムと水が生成されます。
Ca(OH) 2 +CO 2 →CaCO 3 +H 2 ○
- アルカリ/塩基とアンモニウム塩の反応: アンモニアは、アルカリがアンモニウム塩と反応すると生成されます。
アルカリ+アンモニウム塩 → 塩+水+アンモニア
水酸化カルシウムと塩化アンモニウムが反応すると、塩化カルシウム水とアンモニアが生成されます。
Ca(OH) 2 +NH 4 Cl → CaCl 2 +H 2 O+NH 3
塩基の例
塩基は通常、金属酸化物、金属水酸化物、金属炭酸水素塩、金属炭酸塩などです。塩基の例とその用途を表形式でいくつか見てみましょう。
| 拠点 | アプリケーション |
|---|---|
| 水酸化カリウム コー | アルカリ電池に使用 |
| 水酸化ナトリウム NaOH | 石鹸や洗剤の製造に使用される |
| 水酸化マグネシウム Mg(OH) 2 | 制酸薬として使用される |
| 重炭酸ナトリウム NaHCO 3 | 重曹として使用 |
| 炭酸ナトリウム すでに 2 CO 3 | 洗濯ソーダとして使用 |
| アンモニア NH 3 | 洗浄剤および医薬品の製造に使用されます |
| 水酸化カルシウム Ca(OH) 2 | ホワイトウォッシングに使用 |
塩基の用途
Base にはさまざまな使用例があり、その一部を以下に示します。
- 水酸化ナトリウムは石鹸や紙の製造に使用されます。水酸化ナトリウム (NaOH) はレーヨンの製造にも使用されます。
- さらし粉はCa(OH)から作られています2、一般に消石灰または水酸化カルシウムとして知られています。
- 水酸化カルシウムは、塗装や装飾用の乾燥混合物を作成するために使用されます。
- マグネシアミルクとして広く知られている水酸化マグネシウムは、広く使用されている下剤です。人間の胃内の過剰な酸性度を下げるため、制酸剤としても使用されます。
- 研究室では、水酸化アンモニウムは重要な試薬です。
- 消石灰は土壌中の過剰な酸性度を中和するために使用できます。
続きを読む
- 酸、塩基、塩
- 酸の強さ
- 酸と塩基のイオン化
化学の塩基に関するよくある質問
1. 塩基とは何ですか?
- 塩基性化合物には苦い風味があります。
- ほとんどのベースのテクスチャーは石鹸状です。
- リトマス試験紙でテストすると、ほとんどの場合、赤いリトマス試験紙が青いリトマス試験紙に変わります。
- 溶液中では、塩基化合物も電気を伝導します。
- 塩基性化合物が水に溶解すると、OH- イオンが遊離します。
2. 塩基の機能とは何ですか?
家庭では洗浄剤や制酸剤として塩基を使用しています。石鹸、灰汁(オーブン用洗剤に使用される)、マグネシアミルク、タムスはすべて、人気のある自家製ベースの例です。それぞれの pH は 7 を超え、遊離水素を消費し、酸を中和することができます。
3. 酸と塩基の最も重要な違いは何ですか?
酸と塩基 は 2 種類の腐食性化学物質です。酸性物質の pH 値は 0 ~ 7 ですが、塩基の pH 値は 7 ~ 14 です。酸は水中で分解して水素イオン (H+) を生成するイオン性化学物質であり、塩基は解離して OH- イオンを生成します。
4. 塩基の物理的性質は何ですか?
- 彼らには苦い味がある。
- その水溶液には石鹸のような性質があります。
- リトマス試験紙の色を赤から青に変えます。
- それらの水溶液は導電性です。
- 水素ガスの放出により、塩基が金属と反応して塩が生成されます。
5. 水酸化カルシウムが塩化アンモニウムと反応するとどうなりますか?
水酸化カルシウムと塩化アンモニウムが反応すると、塩化カルシウム水とアンモニアが生成されます。
Ca(OH) 2 +NH 4 Cl → CaCl 2 +H 2 O+NH 3
6. 水酸化ナトリウムが亜鉛金属と反応すると何が起こりますか?
水酸化ナトリウムが金属亜鉛と反応すると、水素ガスと亜鉛酸ナトリウムが生成されます。
2 NaOH + 亜鉛 → Na 2 ZnO 2 +H 2
7. ルイスベースとは何ですか?
ルイス塩基は、電子不足化合物に電子対を与える化合物です。例にはNHが含まれます3.
8. ベースは何でできていますか?
塩基は一般にOHで構成されています–イオン。これらの金属酸化物とは別に、炭酸塩および炭酸水素塩も塩基です。
9. アルカリとは何ですか?
水に溶ける塩基をアルカリといいます。例としては、水酸化ナトリウム NaOH があります。
10. 強塩基と弱塩基とは何ですか?
完全に解離してOHを与える塩基–水に溶けたイオンを強塩基といいます。例にはNaOHが含まれます。弱塩基とは、完全に解離してOHを遊離しない塩基のことです。–イオンを弱塩基といいます。弱塩基の例には、水酸化アンモニウムが含まれます。
