アウフバウの原理は、電子が原子軌道にどのように充填されているかを説明する基本的な方法です。アウフバウの原理によれば、原子の基底状態における電子の充填は基本パターンに従います。この原理は、任意の原子の原子軌道内の電子はエネルギーの昇順に満たされており、原子軌道のエネルギーを見つけるには n+1 規則に従うことを示しています。
構造原理
この記事では、アウフバウ原則、アウフバウ原則の特徴、その例外と制限について詳しく学びます。
構造原理の定義
アウフバウの原則は次のように述べています。
異なる軌道の電子は、エネルギーの増加順に満たされます。つまり、エネルギーが最も低い軌道が最初に満たされ、エネルギーが最も高い軌道が最後に満たされます。
「アウフバウ」とはドイツ語で「築き上げる」という意味です。軌道の形成とは、軌道を電子で埋めることを意味します。原子軌道内の電子は、原子軌道のエネルギーの小さい順に満たされていると述べています。そして、原子軌道のエネルギーは、n+1 値の大きい電子ほど高いエネルギーを持つかどうかを示す n+1 規則を使用して計算されます。前の行で説明したルールでは、 n 主量子数を伝え、 私 方位量子数を伝えます。
2 つの電子が同じ n+1 値を持つ場合、より小さい値を持つ電子が n エネルギーが小さいため、最初に満たされます。原子軌道に電子を充填する順序については、以下で説明します。
原理図の構造
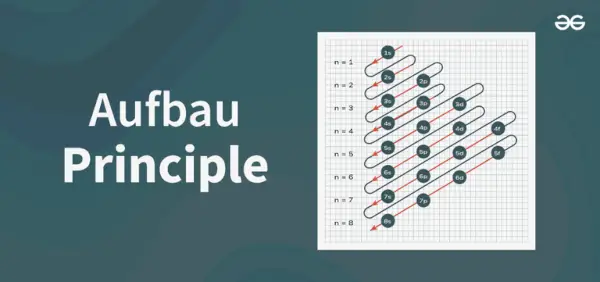
アウフバウ原理図は、原子内に電子が充填される順序を表した図です。
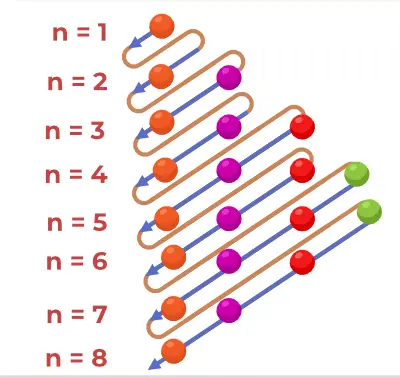
原理図の構造
原理式の構造
アウフバウの原理式は、電子が原子軌道内を埋める順序を示す式です。原子軌道式は、
1s、2s、2p、3s、3p、4s、3d、4p、5s、4d、5p、6s、4f、5d、6p、7s、5f、6d、7p……。
原則クラス 11 の構造
アウフバウの原理は、クラス 11 の生徒にとって重要な化学原理です。この原理は次のように述べています。
原子の原子軌道上の電子は、(n+1) 則で計算される原子軌道のエネルギーの小さい順に埋められます。
構造図を描く
アウフバウ図は、以下に追加されたステップを使用して描画されます。
- 原子に充填される電子の数を求めます。
- 私たちは原子の中で次のことを知っています。
- s軌道は最大2個の電子を保持できます。
- p軌道は最大6個の電子を保持できます。
- d軌道は最大10個の電子を保持できます。
- f軌道は最大14個の電子を保持できます。
- 1s 軌道の最初の 2 つの電子を埋めます。
- 次に、n+l ルールに従い、それに応じて電子を埋めます。
構造原理の顕著な特徴
アウフバウ原理のさまざまな特徴は次のとおりです。
tostring Javaメソッド
- 軌道のエネルギーは、主量子数 (n) と方位和数 (I) の値の合計に依存します。これはと呼ばれます (n + l) ルール 。このルールによれば、
- 中性の孤立原子では、軌道の (n + l) の値が小さいほど、そのエネルギーは低くなります。ただし、2 つの異なるタイプの軌道が同じ値 (n + l) を持つ場合、n の値が小さい軌道のエネルギーは小さくなります。
| 軌道の種類 | nの値 | lの値 | n+1の値 | 相対エネルギー |
|---|---|---|---|---|
| 1秒 | 1 | 0 | 1+0 = 1 | 最低エネルギー |
| 2秒 | 2 | 0 | 2+0 = 2 | 1s軌道よりも高いエネルギー |
| 2P 3秒 | 2 3 | 1 0 | 2+1 = 3 3+0 = 3 | 2p 軌道 (n=2) は 3s (n=3) 軌道よりもエネルギーが低くなります。 |
| 3P 4秒 | 3 4 | 1 0 | 3+1 = 4 4+0 = 4 | 3p 軌道 (n=3) は 4s (n=4) 軌道よりもエネルギーが低くなります。 |
| 3D 4P | 3 4 | 2 1 | 3+2 = 5 4+1 = 5 | 3d 軌道(n=3) は 4p(n=4) 軌道よりもエネルギーが低くなります。 |
表の説明から、主量子数の増加に伴ってさまざまな軌道のエネルギーが増加することがわかります。
- したがって、電子が原子軌道に充填される順序は、 原子 は、 1s、2s、2p、3s、3p、4s、3d、4p、5s、4d、5p、6s、4f、5d、6p、7s、5f、6d、7p…
アウフバウ原理を使用した電子構成
の 電子構成 いくつかの要素に対する Aufbau 原則の使用については、以下で説明します。
硫黄の電子配置
原子番号 硫黄の値は 16、つまり電子が 16 個あります
ここで、アウフバウ原理を使用すると、硫黄の電子配置は次のように記述されます。
[S] = 1秒 2 2秒 2 2P 6 3秒 2 3P 4
窒素の電子配置
窒素の原子番号は7、つまり7個の電子を持っています
ここで、アウフバウ原理を使用すると、窒素の電子配置は次のように記述されます。
[N] = 1秒 2 2秒 2 2P 3
建設原則の例外
アウフバウ原則には、クロムと銅などの例外がいくつかあります。それらの電子構成は、
クロムの電子配置
アウフバウ原理に従ったクロムの電子配置は次のようになります。
- Cr(24): [Ar]3d 4 4秒 2
しかし、クロム(Cr) の実際の電子配置は次のとおりであるため、上記の配置は正しくありません。
- Cr(24): [Ar]3d 5 4秒 1
この電子構成の理由は次のとおりです。 半分満たされた d 原子軌道はより安定です アウフバウの原理に従って満たされた軌道よりも。
銅の電子配置
アウフバウ原理による銅の電子配置は次のようになります。
- Cu(29): [Ar]3d 9 4秒 2
銅(Cu)の実際の電子配置は次のとおりであるため、上記の配置は正しくありません。
- Cu(29): [Ar]3d 10 4秒 1
この電子構成の理由は次のとおりです。 完全に満たされた d 原子軌道はより安定です アウフバウの原理に従って満たされた軌道よりも。
続きを読む
構造原則 - よくある質問
化学におけるアウフバウの原理とは何ですか?
化学におけるアウフバウの原理は、あらゆる原子の原子軌道に電子を充填するために使用される基本原理です。この定理は、電子が原子軌道内に充填される順序を示します。
アウフバウ原理を与えたのは誰ですか?
アウフバウ原理は、1920 年に有名なデンマークの物理学者ニールス ボーアによって与えられました。
パウリの排除原理とは何ですか?
パウリの排他原理では、原子内に 4 つの量子数すべてを持つ電子は 2 つ存在しないと述べています t 彼も同じだ。少なくとも、量子数の 1 つは原子内のすべての電子で異なります。
n+l ルールとは何ですか?
n+l ルールは、軌道のエネルギーが主量子数 (n) と方位量子数 (l) の合計に依存するというルールです。この規則は (n+l) 規則と呼ばれます。
アウフバウ原則の例外は何ですか?
アウフバウ原則の例外は次のとおりです。
- クロムCrの電子配置[24]
- 銅Cuの電子配置[29]
