原子軌道 は数学関数であり、原子内の電子 (または電子対) の波動を記述します。原子軌道は種類によって形状が異なります。原子軌道のさまざまな形状は、ある方向で原子核の周りに電子が見つかる確率が最高かゼロであることを示しています。軌道には 4 種類あり、それぞれ形状が異なり、s、p、d、f の文字で表されます。 s 軌道と p 軌道は化学化学および生物化学に最も豊富に存在するため、考慮されます。アン s軌道 中心に球状の核があり、 p軌道 ダンベル型で、5 つのうち 4 つが d軌道 クローバーの葉の形をしています。第 5 d 軌道は、中央にドーナツが付いた長いダンベルのような形をしています。原子の軌道は層または電子殻に組織されます。
2か月ぶり
原子軌道とは何ですか?
原子軌道とは、電子を発見する可能性が最大となる原子核近くの 3 次元空間です。
量子原子モデルによれば、原子は無限の数の軌道を持つことができます。これらの軌道は、そのサイズ、形状、または方向に基づいて分類できます。軌道が狭いということは、原子核の近くで電子を捕捉できる確率が高いことを意味します。軌道波動関数は、電子の座標を表すために使用される数学関数としてよく知られています。電子の位置が特定される可能性は、軌道波動関数の二乗で表されます。この波動関数は、境界面図の作成にも役立ちます。
軌道波動関数
の 量子原子モデル 原子は非常に多様な軌道を持つ可能性があると予測しています。これらの軌道は、サイズ、形状、または傾斜に応じてグループ化できます。軌道サイズが小さくなると、原子核の近くに電子が得られる確率が高くなります。電子の座標を表すために使用される数学関数は、 軌道波動関数 。電子が発見される確率は、軌道波動関数の二乗で表されます。
この波動関数を使用して境界面図を作成することもできます。さまざまな軌道の確率密度一定の境界面図を使用すると、軌道の形をよりよく理解できます。
原子軌道の形状
原子軌道の形状はさまざまです。つまり、原子核の周囲に描かれる電子の確率分布が異なります。異なる軌道の電子は親原子核の周囲の異なる領域に位置している可能性が高く、そのため親原子核の引力がさまざまな強さで受けるという事実が、軌道のエネルギーにばらつきがある理由の 1 つです。水素原子の特定の殻内のすべての軌道が、さまざまな形をとりながらも同じエネルギーを持っていることは驚くべきことです。これは、さまざまなエネルギー関連の拠出金の削減によるものです。
しかし、第 2 電子が存在するとすぐに、縮退は消えます。
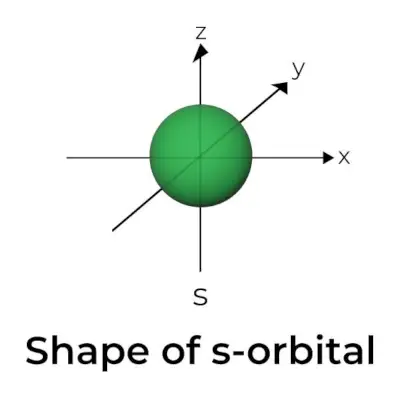
s軌道の形状
- s 軌道境界面図は中心に原子核をもつ球に似ており、二次元では円として表すことができます。
- s 軌道は球対称です。これは、特定の距離で電子を見つける確率がどの方向でも同じであることを意味します。
- s 軌道のサイズも同様に、一次量子数 (n) の値が増加するにつれて増加することが示されています。したがって、4 秒> 3 秒> 2 秒> 1 秒になります。
- 節点とは、電子を見つける可能性がない場所です。ノードは、放射状ノードと角度型ノードの 2 種類に分類されます。核からの距離は放射状ノードによって計算され、方向は角度ノードによって決定されます。
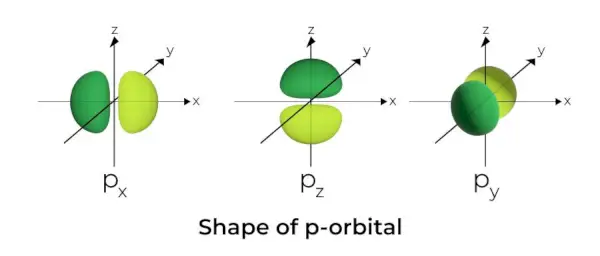
p軌道の形状
- p軌道はダンベルのように形成されます。
- p 軌道ノードは核の中心に位置します。
- 3 つの軌道が存在するため、p 軌道は最大 6 個の電子を占有することができます。
- 各 p 軌道は、核を横切る平面の両側に位置するローブとして知られる 2 つの部分で構成されています。
- 各 p 軌道には、核を横切る平面の両側にローブとして知られる部分があります。 2 つのローブが交差する平面では、電子が見つかる可能性はゼロです。
- 3 つの軌道は、同じサイズ、形状、エネルギーを持つため、縮退軌道として知られています。
- 軌道間の唯一の違いは、ローブの方向です。ローブは x、y、または z 軸に沿って配向されているため、2 という名前が付けられます。ピクセル、2パイ、および2z。ノード数の計算には、式 n –2 が使用されます。
- s 軌道と同様に、p 軌道のサイズとエネルギーは、一次量子数が増加するにつれて増加します (4p> 3p> 2p)。
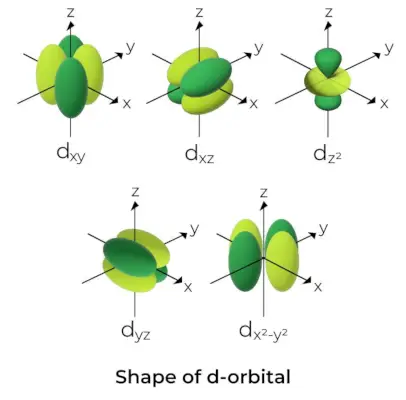
d軌道の形状
- d 軌道の場合、磁気軌道量子数は (-2,-1,0, 1,2) として与えられます。その結果、d 軌道は 5 つあると主張できます。
- これらの軌道は記号 d で示されます。xy、dyz、dxz、dバツ2-そして2、およびdと2。
- 最初の 4 つの d 軌道の形は互いに似ていますが、d 軌道とは異なります。と2軌道ですが、5 つの d 軌道すべてのエネルギーは同じです。
f軌道の形状
- f 軌道の形は分散しています。 f 軌道の値 l=3 であるため、主量子数 n の最小値は 4 になります。
- f 軌道の同等の ml 値は (-3、–2、–1、0、+1、+2、+3) です。
- 結果として、l = 3 の場合、f 軌道は 7 つになります。

縮退軌道
縮退軌道とは、同じエネルギーを持つ軌道のことです。これらの軌道は別個です (軌道の周囲の空間では異なる方向を向いている可能性があります)。 原子核 )、それでも同じエネルギーを持っています。外部場の存在下では、p 軌道の縮退は影響を受けません。ただし、f 軌道と d 軌道の縮退は、系に外部場 (電場または磁場のいずれか) を適用することによって破ることができます。
より高いエネルギーを持つ軌道はほとんどありませんが、他の軌道はより低いエネルギーを持ちます。システムには退化はもう存在しません。たとえば、d 軌道は、すべて同じエネルギーを持つ 5 つの縮退軌道で構成されます。
続きを読む:
- 分子軌道理論
- 原子内の軌道の充填
- ハイブリダイゼーション
原子軌道の形状に関するよくある質問
質問 1: 軌道はどのように機能するのですか?
答え:
原子軌道とは、原子理論および量子力学において、原子内の 1 つの電子または電子対の波動的な振る舞いを表す数式です。各軌道は最大 2 つの電子を取り込み、それぞれが独自のスピン量を持ちます。
np ゼロ
質問 2: 節点平面とは何ですか?
答え:
電子を見つける確率が無視できるかゼロである平面は、節平面と呼ばれます。
質問 3: 軌道はいくつありますか?
答え:
s サブレベルには軌道が 1 つしかないため、電子は 2 つだけ存在できます。 p 副準位は 3 つの軌道で構成されているため、最大 6 つの電子が存在できます。 d 副準位は 5 つの軌道で構成されているため、最大 10 個の電子が存在できます。そして、4 つのサブレベルのそれぞれには、最大 14 個の電子を保持できる 7 つの軌道があります。
質問 4: どの軌道が最も高いエネルギーを持っていますか?
私のライブクリクレット
答え:
軌道 1 は最も多くのエネルギーを持っています。電子のエネルギーは、原子の電気バブルから電子を取り出すのに必要なエネルギー量です。
質問 5: シェルと軌道の違いは何ですか?
答え:
原子において、シェルは同じ量子数理論 n のサブシェルの集合です。それぞれの軌道には 2 つの電子があり、同じ軌道内の電子はサイズ、角運動量サイズ、磁気量子数の定義が同じです。
Javaを配列にリストする
質問 6: シグマ結合とパイ結合とは何ですか?
答え:
原子軌道の重なりによりシグマ結合とパイ結合が形成されます。シグマ結合は原子軌道ローブの重なりによって生成されますが、パイ結合は、原子軌道ローブが別の原子軌道ローブと重なるときに生成されます。
