の概念 ハイブリダイゼーション 2 つの原子軌道を結合して新しいタイプの混成軌道を作成するプロセスとして定義されます。この混合により、通常、完全に異なるエネルギー、形状などを備えた混成軌道が形成されます。混成は主に同じエネルギー準位の原子軌道によって行われます。ただし、エネルギーが等しい場合、完全に満たされた軌道と半分満たされた軌道の両方がこのプロセスに参加できます。ハイブリダイゼーションの概念は、結合形成、結合エネルギー、結合長を理解するのに役立つ原子価結合理論の拡張です。
ハイブリダイゼーションとは何ですか?
2 つの原子軌道が結合して分子内に混成軌道を形成すると、個々の原子の軌道のエネルギーが再分配されて、同等のエネルギーの軌道が得られます。これはハイブリダイゼーションとして知られています。
同等のエネルギーの原子軌道は、ハイブリッド形成プロセス中に一緒に混合されます。これには、主に 2 つの軌道または 2 つの「p」軌道の合併、または「s」軌道と「p」軌道および「s」軌道の混合が含まれます。 「d」軌道を持つ軌道。
混成軌道 は、このプロセスの結果として形成される新しい軌道です。さらに重要なことは、混成軌道を使用して原子結合特性と分子幾何学を説明できることです。たとえば、炭素 は、価殻 s 軌道が 3 つの価殻 p 軌道と結合する 4 つの単結合を形成します。この組み合わせにより、4 つの等価な sp が生成されます。3混合物。これらは、4 つの異なる原子に結合している炭素の周囲に四面体パターンで配置されます。
ハイブリダイゼーションのタイプを決定する手順
原子またはイオンにおけるハイブリダイゼーションの種類を理解するには、次の規則に従う必要があります。
npどこ
- まず、原子またはイオンに含まれる価電子の総数を決定します。
- 次に、その原子またはイオンに結合している非共有電子対の数を数えます。
- ここで、必要な軌道の数は、二重またはオクテットの数と孤立電子対の数を加算することによって計算できます。
- 孤立電子対が存在しない場合、原子またはイオンの軌道の幾何学形状が異なることに注意してください。
ハイブリダイゼーションの特徴
- 混成は、等しいエネルギーを持つ原子軌道間で起こります。
- 形成される混成軌道の数は、混合する原子軌道の数に等しい。
- すべての半分に満たされた軌道がハイブリダイゼーションに参加する必要はありません。完全に満たされていてもエネルギーがわずかに変化している軌道でも参加できます。
- ハイブリダイゼーションは結合形成中にのみ発生し、単一のガス原子内では発生しません。
- 分子のハイブリダイゼーションがわかっていれば、分子の形状を予測できます。
- 混成軌道の大きいローブは常に正であり、反対側の小さいローブは常に負です。
種類 ハイブリダイゼーションの
ハイブリダイゼーションはspとして分類できます。3、sp2、sp.、sp3d、sp3d2、またはsp3d3混合に関与する軌道の種類に基づきます。
夕食対夕食
spハイブリダイゼーション
これは、原子の主殻内の 1 つの s 軌道と 1 つの p 軌道が結合して、2 つの新しい同等の軌道を形成するときに発生します。新しく形成された軌道はsp混成軌道として知られています。 180°の角度で直線状の分子を生成します。これには、自分の軌道と等しいエネルギーの 1 つの「p」軌道を組み合わせて、sp 混成軌道として知られる新しい混成軌道を生成することが必要です。
- 対角ハイブリッド化とも呼ばれます。
- 各 sp 混成軌道には、同量の s 文字と p 文字が含まれます。
- BeF などのすべてのベリリウム化合物2、 良い2、および BeCl2、などが例です。

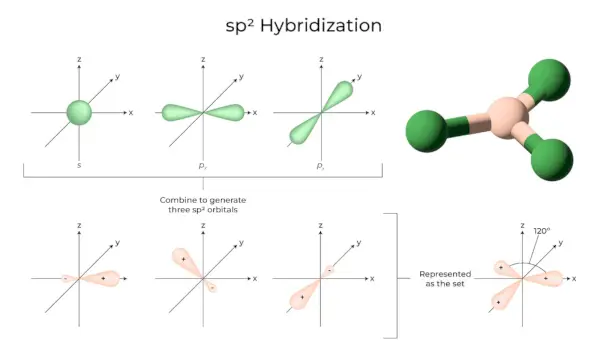
sp2ハイブリダイゼーション
これは、同じ原子の殻の 1 つの s 軌道と 2 つの p 軌道が結合して 3 つの同等の軌道を形成するときに発生します。新しく形成された軌道はspとして知られています2混成軌道。三角ハイブリダイゼーションとも呼ばれます。これには、自分の軌道を同じエネルギーの 2 つの「p」軌道と組み合わせて、sp として知られる新しいハイブリッド軌道を作成することが必要です。2。 s 軌道と p 軌道の三方対称混合物は 120 度に保たれます。 3 つの混成軌道はすべて同じ平面内にあり、互いに 120° の角度を形成します。
- 形成された各混成軌道には、33.33 % と 66.66 % の「p」文字があります。
- 三角形の平面形状を持つ分子は、他の 3 つの原子と結合した中心原子を持ち、sp2ハイブリッド化した。ホウ素化合物がその例です。
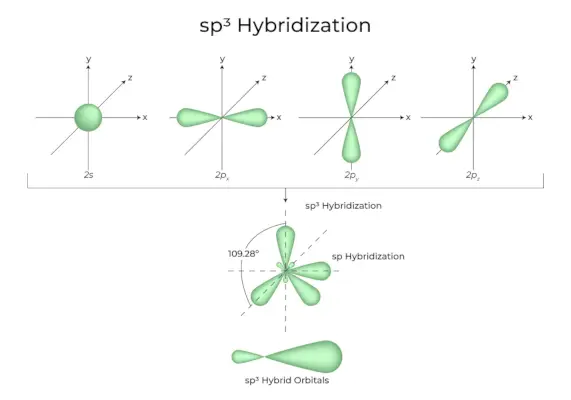
sp3ハイブリダイゼーション
原子の同じ殻にある 1 つの「s」軌道と 3 つの「p」軌道が結合して 4 つの新しい同等の軌道を形成する場合、そのハイブリダイゼーションは四面体ハイブリダイゼーションまたは sp として知られています。3。新しく形成された軌道はspとして知られています3混成軌道。これらは正四面体の 4 つの角で尖っており、互いに 109°28' の角度を形成します。
- スプ3混成軌道は 109.28 度の角度を形成します。
- 各混成軌道には 25% の s 特性と 75% の p 特性があります。
- エタンとメタンが 2 つの例です。
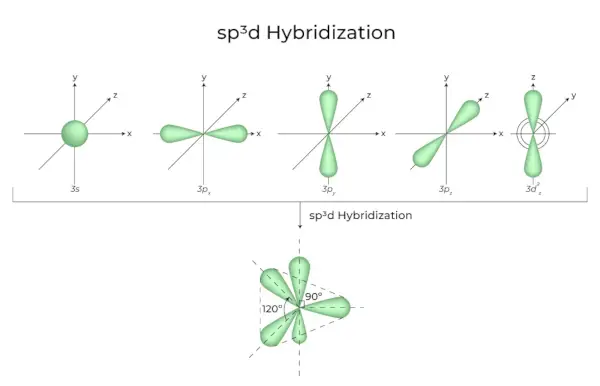
sp3d ハイブリダイゼーション
1s 軌道、3p 軌道、および 1d 軌道を混合すると、等しいエネルギーの 5 つの sp3d 混成軌道が生成されます。それらの幾何学的形状は三角両錐形です。 s、p、d 軌道の組み合わせにより、三角両錐対称性が生じます。赤道軌道は、互いに 120° の角度で配向され、水平面内にある 3 つの混成軌道です。
- 軸軌道として知られる残りの 2 つの軌道は、赤道軌道の 90 度面の垂直面にあります。
- 五塩化リン(PClなど)中でのハイブリダイゼーション5)。
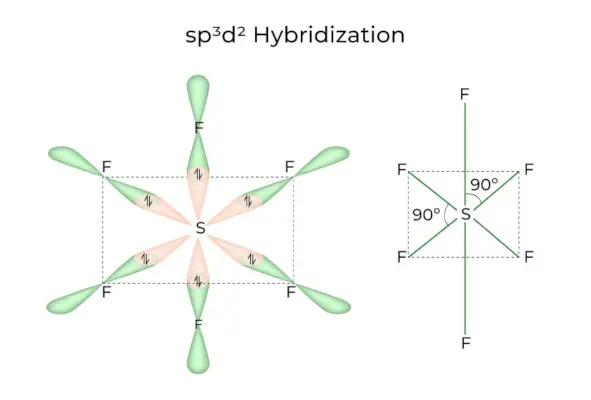
sp3d2 ハイブリダイゼーション
1s、3p、2d 軌道が結合して 6 つの同一の sp を形成するとき3d2混成軌道、混成はspと呼ばれます3d2ハイブリダイゼーション。これら 7 つの軌道は、八面体の角を指します。これらは互いに 90 度の角度で傾いています。
img css 整列
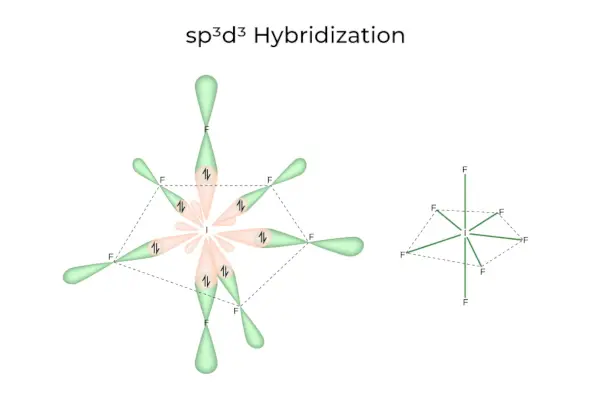
sp3d3ハイブリダイゼーション
1s、3p、3d の軌道があり、これらが結合して 7 つの同一の sp を形成します。3d3混成軌道。これら 7 つの軌道は、五角両錐の角を指します。例えばもし6。
ハイブリダイゼーションの形態
- Linear : sp ハイブリダイゼーションは 2 電子基の相互作用によって引き起こされます。軌道角は180°です。三角平面: 3 つの電子グループが関与し、結果として sp2ハイブリダイゼーション;軌道は120°離れています。四面体: 4 つの電子グループが関与し、結果として sp3ハイブリダイゼーション;軌道角は109.5°です。三角両錐体: 5 つの電子グループが関与し、結果として sp3d ハイブリダイゼーション;軌道角は90°と120°です。八面体: 6 つの電子グループが関与し、結果として sp3d2ハイブリダイゼーション;軌道は90°離れています。
よくある質問 ハイブリダイゼーション
質問 1: sp、sp2、sp3 の中で、どの混成軌道がより電気陰性度が高いですか?
答え:
sp, sp における s 文字の割合2、sp3ハイブリッドカーボンはそれぞれ 50%、33.33%、25% です。 s 軌道は球形であるため、原子核によって全方向から均等に引き寄せられます。その結果、s 字混成軌道は原子核に近くなり、電気陰性度が高くなります。結果として、sp 混成炭素が最も電気陰性度が高くなります。
質問 2: 混成軌道とは何ですか?
答え:
スキャナースキャンJava
ハイブリッド軌道は、標準原子軌道を組み合わせて新しい原子軌道を形成することによって形成されます。
質問 3: ハイブリッド化の 5 つの形状は何ですか?
答え:
直線、平面三角、四面体、三角両錐、八面体がハイブリダイゼーションの 5 つの基本形状です。
質問 4: アミド分子はなぜ sp のように見えるのですか3ハイブリッドですがspです2?
Javaの構造
答え:
原子が 2 つ以上の p 軌道に囲まれているか、p 軌道に飛び込むことができる非共有電子対を持っている場合、ハイブリダイゼーションの一般的なプロセスが変化します。その結果、アミド分子の場合、非共有電子対が p 軌道に入り、隣接する 3 つの平行な p 軌道が形成されます。
質問 5: ベントの法則とは何ですか?
答え:
分子内の多数の基に接続された中心原子はハイブリダイズし、より多くの s 特性を持つ軌道が電気陽性基に向けられ、より多くの p 特性を持つ軌道が電気陰性基に向けられます。
